Baterai merupakan alat elektronika yang sangat bermanfaat dalam menyimpan energi. Tanpa baterai mungkin saat ini kita harus menghubungkan kabel ke smartphone disaat ingin memakainya. Beruntunglah teknologi saat ini memungkinkan baterai selalu bisa diisi ulang atau dikenal rechargeable battery ketika low batteries (Low-Bat) atau mati.
Baterai berbeda dengan kapasitor, namun sama-sama berfungsi sebagai penyimpan energi. Kapasitor menyimpan energi lebih banyak dibandingkan dengan baterai yang biasa kita gunakan. Baterai berhubungan dengan sumber arus searah atau DC, sedangkan kapasitor dikaitkan dengan arus bolak balik atau AC.
Tahukah kamu asal mula baterai?
 Baterai Volta
Baterai Volta
Pada tahun 1799, fisikawan Italia Alessandro Volta menciptakan baterai pertama dengan menumpuk bolak lapisan seng, air garam, karton atau kain basa, dan perak. Pengaturan ini, disebut tumpukan volta, bukan perangkat pertama untuk menciptakan listrik, tapi itu yang pertama untuk menghasilkan listrik yang stabil, dan hingga saat ini menjadi patokan baterai modern.
Namun, ada beberapa kelemahan dari penemuan Volta. Ketinggian di mana lapisan bisa ditumpuk terbatas karena berat tumpukan akan memeras air garam keluar dari karton atau kain. Cakram logam juga cenderung menimbulkan korosi yang cepat, tentu saja memperpendek umur baterai. Meskipun maish terdapat kekurangan, unit SI dari gaya gerak listrik yang sekarang disebut volt adalah untuk menghormati prestasi Volta.
Terobosan penemuan baterai berikutnya dilanjutkan oleh kimiawan asal Inggris John Frederic Daniell. Pertama kali menemukan baterai lebih efisien yaitu piring tembaga ditempatkan di bagian bawah botol kaca dan sulfat tembaga dituangkan di atas piring mengisi setengah tabung. Kemudian plat seng digantung dalam stoples, dan seng sulfat ditambahkan. Karena tembaga sulfat lebih padat dari seng sulfat, seng melayang ke atas tembaga dan dikelilingi pelat seng. Kawat terhubung ke pelat seng diwakili terminal negatif, sedangkan yang dihasilkan dari pelat tembaga adalah terminal positif.
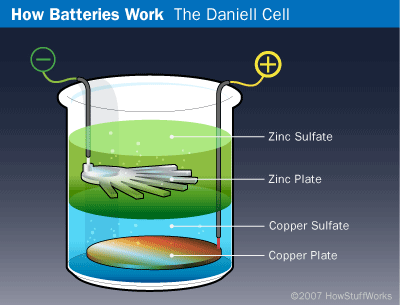 Baterai John Frederic Daniell
Baterai John Frederic Daniell
Pengaturan ini tidak akan berfungsi dengan baik pada senter, tetapi untuk aplikasi stasioner, baterai dari John Daniell bekerja dengan baik. Bahkan, sel Daniell adalah cara yang umum untuk penggunaan bel pintu dan telepon sebelum generasi listrik disempurnakan.
Kemudian pada tahun 1866 Ilmuwan Perancis Georges Leclanché mengganti tembaga sulfat dan tembaga bagian luarnya dengan batang karbon yang disimpan dalam larutan yang mengandung Mangan IV yang akan mengurangi oksidasi mangan III. Penemuan baterai ini menghasilkan tegangan sebesar 1,4 Volt dan berhasil digunakan untuk awal telegraf dan telepon. Akan tetapi baterai ini masih belum rapi dan berbentuk kaca yang mengandung larutan kimia berbahaya.
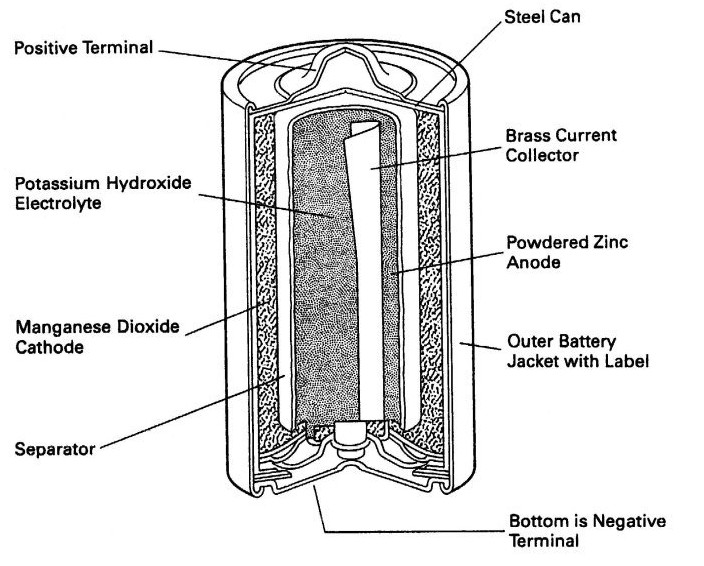
Tahun 1892, baterai bentuk sel kering diberikan hak patennya kepada ilmuwan asal Jerman Karl Gassner, baterai tersebut menggunakan oksida mangan IV dipisah oleh pasta/elektrolit. Baterai ini pula yang sering digunakan sebagai sumber arus searah dan sekali pakai dengan tegangan standar 1,5 Volt (baterai jenis AAA, AA, C, D) seperti untuk remote ataupun lampu senter. Baterai sel kering ini terdiri dari tiga hal yakni:
- Batang karbon sebagai anoda (kutub positif baterai)
- Seng (Zn) sebagai katoda (kutub negatif baterai)
- Pasta sebagai elektrolit yang memisahkan katoda dan anoda
 elemen baterai
elemen baterai
Tahun 1898, sel kering menjadi baterai yang tersedia secara komersial pertama dan dijual di Amerika Serikat. Produsen, National Carbon Company, kemudian berganti nama menjadi Eveready Battery Company adalah yang memproduksi baterai dengan nama merek Energizer.
Seiring dengan perkembangan teknologi, baterai pun memiliki beragam jenis berdasarkan komponen kimia penyusunnya, diantaranya:
- Baterai seng-karbon: baterai kimia seng-karbon adalah baterai umum di banyak murah seperti sel kering AAA, AA, C dan D. Anoda seng, katoda adalah mangan dioksida, dan elektrolit adalah amonium klorida atau seng klorida.
 komponen baterai seng-karbon
komponen baterai seng-karbon
-
Baterai Alkaline: baterai kimia ini juga umumnya dipakai di banyak rumah dengan jenis sel kering AA, C dan baterai sel kering D. Katoda terdiri dari campuran mangan dioksida, sedangkan anoda adalah bubuk seng. Namanya Alkaline diperoleh dari elektrolit kalium hidroksida, yang merupakan zat alkali.
 Komponen Baterai Alkaline
Komponen Baterai Alkaline
-
Baterai lithium-ion (rechargeable): baterai kimia Lithium sering digunakan dalam perangkat kinerja tinggi, seperti ponsel, kamera digital dan bahkan mobil listrik. Berbagai zat digunakan dalam baterai lithium, tetapi kombinasi umum adalah kobalt oksida lithium sebagai katoda dan karbon sebagai anoda.
 komponen baterai Lithium-ion
komponen baterai Lithium-ion
- Timbal-asam baterai (Lead-acid battery) (isi ulang): ini adalah baterai kimia yang digunakan dalam baterai mobil khusus. Elektroda biasanya terbuat dari timbal dioksida dan logam timbal, sedangkan elektrolit adalah larutan asam sulfat.
Bagaimana Cara Kerja Baterai?
Sebelumnya mari kita cek video penjelasan berikut ini:
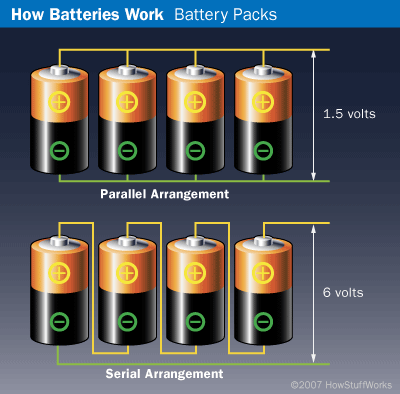 Susunan Seri dan paralel baterai
Susunan Seri dan paralel baterai
Diagram paling atas menunjukkan susunan paralel. Empat baterai secara paralel bersama-sama akan menghasilkan tegangan satu sel, yang berarti memasok energi empat kali pada satu sel. Sesuai dengan prinsip rangkaian baterai yang dipelajari di fisika untuk rangkaian listrik bahwa saat baterai dipasang paralel menghasilkan tegangan yang sama, sedangkan jika dipasang seri menghasilkan penjumlahan dari tegangan baterai yang dirangkai.
Tingkat di mana muatan listrik melewati sirkuit diukur dalam ampere. Baterai dinilai di amp-hour (ampere per jam), atau, dalam kasus baterai rumah tangga kecil, bernilai milliamp per jam (mAh). Sebuah sel rumah tangga tertentu dinilai pada 500 milliamp per jam harus dapat memasok 500 milliamps arus ke beban selama satu jam. Anda dapat memilah-milah rating milliamp per jam dalam banyak cara yang berbeda. Sebuah baterai 500 milliamp jam juga bisa menghasilkan 5 milliamps selama 100 jam, 10 milliamps selama 50 jam, atau, secara teoritis, 1.000 milliamps selama 30 menit. Secara umum, baterai dengan tinggi peringkat amp per jam memiliki kapasitas yang lebih besar dibandingkan miliamp per jam.
Diagram paling bawah menggambarkan pengaturan serial. Empat baterai dalam seri bersama-sama akan menghasilkan arus satu sel, tetapi tegangan yang mereka suplai akan empat kali dari satu sel. Tegangan adalah ukuran energi per satuan muatan dan diukur dalam volt. Dalam baterai, tegangan menentukan seberapa kuat elektron didorong melalui rangkaian, seperti tekanan menentukan seberapa kuat air didorong melalui selang. Kebanyakan baterai yang dipakai AAA, AA, C dan D dengan tegangan 1,5 volt.
Mari kita perhatikan, ketika baterai yang ditunjukkan dalam diagram yang bernilai 1,5 volt dan 500 milliamp per jam. Maka empat baterai dalam susunan paralel akan menghasilkan 1,5 volt pada 2.000 milliamp per jam. Empat baterai diatur dalam seri akan menghasilkan 6 volt di 500 milliamp per jam.
Baterai BTS (Base Transceiver System) Untuk Telekomunikasi
Baterai untuk BTS salah satunya yaitu :
Fuel Cell Hydrogen (tenaga alternatif)
Pengertian Fuel Cell
- Alat yang sejenis fuel cell yang sering kita jumpai adalah baterai. baterai yang mempunyai komponen2 kimia sebagai penyusunnya, akan mengubah energi kimia tersbut menjadi energi listrik. akan tetapi energi baterai akan habis dan untuk mendapatkan energi lagi kita harus menggantinya dengan baterei yang baru atau me recharge ulang baterei tersebut.
- Dengan fuel cell, bahan/senyawa kimia -sebagai sumber energi- akan terus ada selama kita mengisi bahan bakar fuel cell tersebut. senyawa kimia yang paling banyak dipakai dalam fuel cell adalah hidrogen dan oksigen. kedua senyawa tersebut dipilih karena kelimpahannya di alam sangat banyak.
Prinsip kerja fuel cell
- Fuel cell adalah alat konversi energi elektrokimia yang akan mengubah hidrogen dan oksigen menjadi air, secara bersamaan menghasilkan energi listrik dan panas dalam prosesnya. fuel cell merupakan suatu bentuk teknologi sederhana seperti baterai yang dapat diisi bahan bakar untuk mendapatkan energinya kembali, dalam hal ini yang menjadi bahan bakar adalah oksigen dan hidrogen.
- Layaknya sebuah baterai, segala jenis fuel cell memiliki elektroda positif dan negatif atau disebut juga katoda dan anoda. Reaksi kimia yang menghasilkan listrik terjadi pada elektroda. Selain elektroda, satu unit fuel cell terdapat elektrolit yang akan membawa muatan-muatan listrik dari satu elektroda ke elektroda lain, serta katalis yang akan mempercepat reaksi di elektroda. Umumnya yang membedakan jenis-jenis fuel cell adalah material elektrolit yang digunakan. Arus listrik serta panas yang dihasilkan setiap jenis fuel cell merupakan produk samping reaksi kimia yang terjadi di katoda dan anoda.

- Karena energi yang diproduksi fuel cell merupakan reaksi kimia pembentukan air, alat konversi energi elektrokimia ini tidak akan menghasilkan efek samping yang berbahaya bagi lingkungan seperti alat konversi energi konvensional (misalnya proses pembakaran pada mesin mobil). Sedangkan dari segi efisiensi energi, penerapan fuel cell pada baterai portable seperti pada handphone atau laptop akan sepuluh kali tahan lebih lama dibandingkan dengan baterai litium. Dan untuk mengisi kembali energi akan lebih cepat karena energi yang digunakan bukan listrik, tetapi bahan bakar berbentuk cair atau gas.
Cara kerja fuel cell
- Pertama, anoda sebagai kutub negatif fuel cell. Anoda merupakan elektroda yang akan mengalirkan elektron yang lepas dari molekul hidrogen sehingga elektron tersebut dapat digunakan di luar sirkuit. Pada materialnya terdapat saluran-saluran agar gas hidrogen dapat menyebar ke seluruh permukaan katalis.
- Kedua, katoda sebagai kutub elektroda positif fuel cell yang juga memiliki saluran yang akan menyebarkan oksigen ke seluruh permukaan katalis. Katoda juga berperan dalam mengalirkan elektron dari luar sirkuit ke dalam sirkuit sehingga elektron-elektron tersebut dapat bergabung dengan ion hidrogen dan oksigen untuk membentuk air.
- Katalis yang digunakan untuk memfasilitasi reaksi oksigen dan hidrogen. Katalis umumnya terbuat dari lembaran kertas karbon yang diberi selapis tipis bubuk platina. Permukaan katalis selalu berpori dan kasar sehingga seluruh area permukaan platina dapat dicapai hidrogen dan oksigen

Keunggulan Fuel Cell Hidrogen
- Keunggulan penerapan sumber energi alternatif hydro fuel cell antara lain tidak bising karena tidak terdapat komponen bergerak, tidak polutan (tidak beracun, tidak berbau) karena sekresi (zat buangan) yang ditimbulkan adalah H2O alias unsur air, dan memiliki efisiensi proses yang jauh lebih baik dibanding dengan sistem konvensional.
- Berbeda dengan baterai, fuel cell tidak hanya menyimpan tetapi juga menghasilkan energi listrik secara berkesinambungan selama masih ada pasokan bahan bakar. Kelebihan teknologi yang diindonesiakan menjadi sel tunam adalah efisiensinya, tidak bising, hampir tak menghasilkan bahan pencemar sama sekali, serta banyak pilihan bahan bakar.
Pemakaian Fuel Cell
- Di banyak negara maju, teknologi sel tunam sudah bukan barang baru lagi. Negara seperti Amerika Serikat (AS), Jepang, Jerman atau Inggris telah mengembangkan teknologi ini sejak lama. Di negara ini yang menjadi pemicu pemakaian hidrogen sebagai bahan bakar kendaraan adalah isu lingkungan dan konservasi energi.
- Produsen kendaraan seperti General Motors (GM) misalnya sudah merilis prototipe mobil berbahan bakar hidrogen. Mobil yang rencananya akan komersial pada tahun 2010 ini menggunakan sel tunam berbentuk wafer yang berfungsi memisahkan atom hidrogen menjadi proton dan elektron. Dengan memakai elektron sebagai arus listrik, digabungkan proton dengan oksigen dari udara, sehingga hasil sampingnya hanya uap air.
Fuel Cell pada IT
- Bukan hanya kendaraan bermotor saja yang dianggap layak memanfaatkan sel tunam, melainkan juga bidang teknologi informasi (TI). Produsen komputer jinjing (laptop) Jepang misalnya, mengembangkan teknologi ini pada sejumlah produknya. Tidak semua sel tunam bisa dipakai untuk alat elektronik portabel, hanya sel tunam metanol langsung (direct methanol fuel cell) yang termasuk sel tunam alkalin saja yang bisa. Apabila diproduksi secara masal maka harga sel tunam bisa bersaing dengan baterai Lithium-ion yang kini banyak digunakan. Densitas energinya bahkan bisa 5-10 kali lebih besar baterai Lithium-ion.
Fuel Cell pada BTS
- BTS bertenaga hidrogen ini mengunakan teknologi termutakhir dimana gas hidrogen dikonversikan langsung dalam suatu reaksi elektrokimia menjadi tenaga listrik. Sisa pembuangan dari proses ini adalah air murni, yang sama sekali tidak membahayakan lingkungan.
- BTS yang ramah lingkungan itu menggunakan hidrogen sebagai bahan bakar yang akan menyediakan tenaga cadangan apabila pasokan listrik PLN mengalami gangguan.
- Umumnya, generator bertenaga diesel akan difungsikan apabila pasokan listrik PLN terganggu. Namun pada BTS hidrogen, sel bahan bakar dapat digunakan sebagai pasokan tenaga cadangan
 Kapasitas Fuel Cell
Kapasitas Fuel Cell
- Sel bahan bakar ini menggunakan gas hidrogen untuk komersial yang dikirimkan ke lokasi BTS dalam bentuk silinder serta dapat memproduksi 3kw tenaga pada 48 V DC saat mesin bekerja
- Dengan 6 tabung gas hydrogen (1560 cubic feet) akan dapat melayani sebuah site BTS selama 48 jam, sedang dengan pembangkitan genset konvensional untuk waktu yang sama dibutuhkan 240 liter solar
Pemakaian Fuel Cell Hidrogen pada BTS
- Dari beberapa lokasi menara yang paling sering mengalami kekurangan pasokan listrik PLN
- Listrik yang tidak stabil
- Daerah rawan pencurian
- Daerah terpencil
- Daerah yang tidak boleh berisik
Kendala Implentasi pemakaian Fuel Cell hidrogen
- Yang menjadi masalah adalah proses menghasilkan hidrogen. Walau hidrogen merupakan unsur yang paling banyak terdapat di alam semesta namun keberadaannya terikat sebagai senyawa oksida. Maka untuk menghasilkan gas hidrogen diperlukan tenaga listrik yang sebagian besar dihasilkan dari sumber energi penyebab polusi.
- Masalah lain yang akan timbul jika hidrogen digunakan sebagai bahan bakar adalah kebutuhan infrastruktur untuk pendistribusian hidrogen ke tempat penggunanya.
- Kendala utama metode elektrolisis H2O konvensional saat ini adalah efisiensi total yang rendah (~30%), umur operasional electrolyzer yang pendek dan jenis material yang ada di pasaran masih sangat mahal. Kendala-kendala tersebut membuat hidrogen belum cukup ekonomis untuk dapat bersaing dengan bahan bakar konvesional saat ini.
RANGKAIAN INSTALASI PEMAKAIAN BATERAI
RANGKAIAN SERI
Pada Rangkaian Seri jika dua buah baterai di jumper menjadi satu rangkaian, maka tegangannya akan bertambah tetapi arusnya tetap.
RANGKAIAN PARALEL
Pada Rangkaian Paralel jika dua buah baterai di jumper menjadi satu, maka tegangannya tidak bertambah (tetap) tetapi arusnya bertambah.
RANGKAIAN SERI PARALEL
Pada Rangkaian Seri-Paralel, jika tiga buah baterai di jumper menjadi satu, maka tegangannya bertambah, (terakumulasi hanya dua buah baterai) dan arusnya pun bertambah lebih besar.


PERAWATAN DAN PERBAIKAN BATERAI
- PERIKSA TEGANGAN BATERAI
 Periksa tegangan baterai dengan menggunakan Multitester
Periksa tegangan baterai dengan menggunakan Multitester
Tegangan yang baik 12 – 13,5 Volt
 Bukalah semua tutup baterai lalu
Bukalah semua tutup baterai lalu
- PERIKSA KONDISI BERAT JENIS CAIRAN ELEKTROLIT

Bila Hijau = Sangat Baik
Bila Putih = Baik
Bila Merah = Kurang
Berat jenis standart 1,26-1,28 kg/l
- PERIKSA TERMINAL BATERAI

Sumber :
